茎尖分生组织(SAM)乃植物地上部器官发生之源,干细胞的持续增殖和有序分化是维持SAM稳态的基础,也是植物正常发育的前提。在遗传上,WUS-CLV3的反馈调节是控制干细胞活性的核心通路(Yadav et al., 2011)。此外生长素和细胞分裂素相互拮抗对SAM活性维持发挥着重要作用,细胞分裂素促进中心区(CZ)干细胞增殖,生长素诱导外周区(PZ) 细胞分化,并调控器官原基的有序发生和建成(Schaller et al., 2015)。 然而基因调控网络如何与植物激素协同调控SAM稳态仍不清楚。
近日,威廉希尔中文官方网站李存东教授团队与河北师范大学合作在Plant Physiology在线发表题为“Cell- and non-cell-autonomous ARF3 coordinates meristem proliferation and phyllotactic patterning in Arabidopsis”的研究论文,报道了生长素响应因子3(ARF3)分别以细胞自主和非自主的方式调控花序模式(phyllotactic patterning)和SAM稳态。
已有研究表明ARF3参与众多发育过程,如叶原基、心皮原的基极性建立,花分生组织(FM)的终止发育,此外ARF3的功能缺失还导致SAM活性增强和花序模式紊乱(Nemhauser et al., 2000; Sessions et al., 1997; Tantikanjana and Nasrallah, 2012; Zhang et al., 2018)。有趣的是,原位杂交的结果显示ARF3 mRNA主要存在于PZ区,而ARF3蛋白则分布于整个分生组织,包括组织中心区(OC)和CZ区(Liu et al., 2014)。揭示ARF3独特表达模式的形成机理及生物学功能将有助于理解植物激素如何协同调控SAM稳态和器官发生。
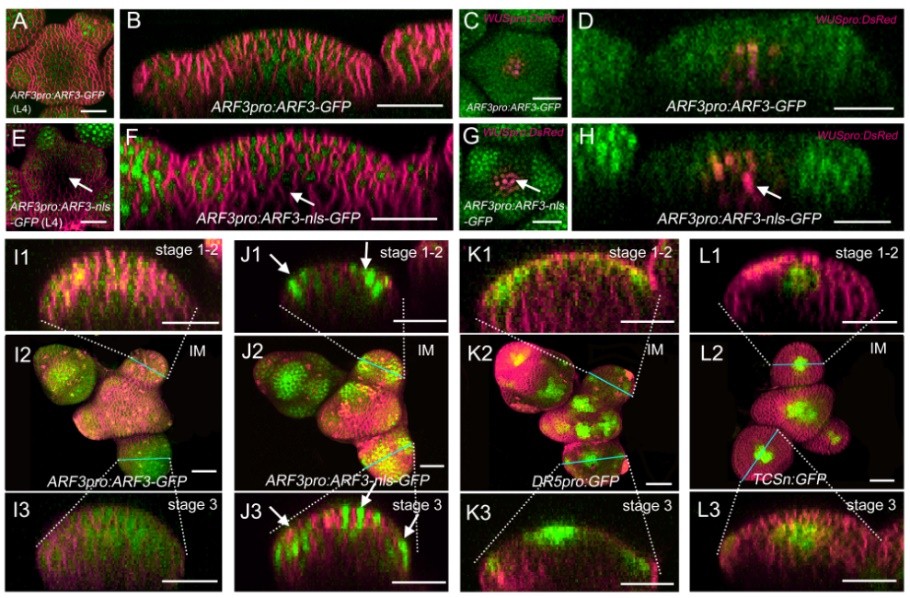
图1. ARF3在分生组织中存在胞间迁移现象
研究人员发现,生长素诱导表达的ARF3在SAM中存在动态迁移现象。通过添加核定位序列(nls)可以限制ARF3-nls-GFP的胞间穿梭能力,导致其在SAM中的分布模式与ARF3-GFP存在明显差异(图1),而在FM中ARF3-nls-GFP的信号分布与DR5:GFP十分吻合(图J,K)。分析表明,ARF3受生长素诱导表达后,可从PZ区迁移到OC和CZ区以执行生物学功能。
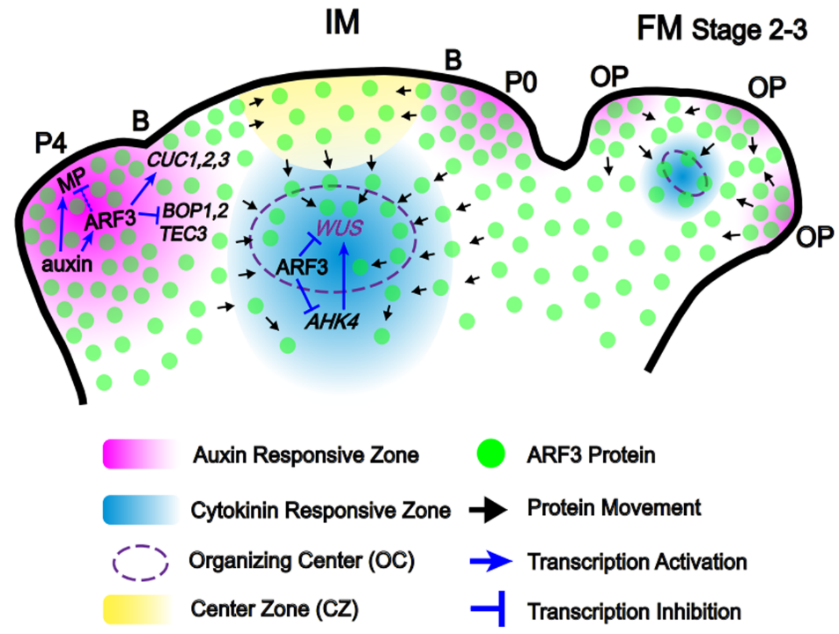
图2. ARF3分别以细胞自主和非自主的方式调控花序模式和SAM稳态。
进一步的研究表明,在PZ区, ARF3通过细胞自主调节ARF5和边界基因(如CUC1-3,BOP1-2和 TEC3)的表达以控制器官的起始和模式化;而在OC区,ARF3通过非细胞自主调节WUS和细胞分裂素受体之一AHK4的表达以维持SAM稳态(图2)。 因此,我们揭示了一个复杂的机制:ARF3介导生长素以细胞自主方式调控花序模式,同时作为非自主性转录因子调控SAM活性的稳态。
该研究由威廉希尔中文官方网站李存东教授团队与河北师范大学刘西岗教授合作完成,这是团队在揭示ARF3介导AGAMOUS对WUS表达的抑制(Liu et al.,2014)和细胞分裂素活性(Zhang et al.,2018)调控FM终止发育后,阐明ARF3调控SAM稳态及花序模式的功能和机制。williamhill官网张科副教授,生命科学学院博士生张昊为该论文的共同第一作者。相关工作得到了国家自然科学基金委,河北省自然科学基金委及华北作物改良与调控国家重点实验室的支持。